В мире каждый год умирает порядка 700 тысяч человек от инфекций, вызванных разного рода бактериями, устойчивыми к существующим на данный момент антибиотикам.
Вот несколько примеров: в результате открытого перелома женщина получила инфекцию бедренной кости. Для лечения была применена антибиотикотерапия, однако она оказалась безрезультатной, и пациентка умерла от септического шока. Как было установлено позже, патогенном была клебсиелла, бактерия нормальной флоры человека, которая обладает устойчивостью ко всем 26 зарегистрированным в Соединенных Штатах Америки антибиотикам.
Каждый год около 23 тысяч человек в США, 25 тысяч человек в Европе и около 700 тысяч человек во всем мире умирает от инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. По оценкам специалистов, примерно через три десятилетия смертность от таких бактерий будет достигать 10 миллионов человек ежегодно. Однако финансирование новых разработок антибиотиков сокращается.
Так почему же бактерии становятся агрессивными и приобретают устойчивость к лекарственным препаратам? И почему в таком случае разработка новых антибиотиков является невыгодной?
Как известно, антибиотики были открыты совершенно случайно. Александр Флеминг отличался неряшливостью, которая вовсе не красит ученого, и тем более бактериолога. В 1922 году, после того, как слизь из его носа попала на колонию бактерий, ученый случайно открыл такой фермент, как лизоцим. А спустя 6 лет, в 1928 году он точно так же случайно занес в культуру стафилококка споры плесени и заметил, что все бактерии вокруг выросшего гриба погибли.
Ученый пришел к выводу, что благодаря плесени происходит синтез бактерицидного вещества за счет вытеснения бактерий, конкурирующих за питательную среду. Флеминг выделил из плесени пенициллин, который оказался более эффективным, нежели те наружные антисептики, которые применялись в то время в хирургии. Пенициллин, в отличие от антисептических препаратов, можно ввести внутрь человеческого организма, и там он борется в различных тканях и органах с инфекциями. Более того, даже после того, как препарат был разведен 800 раз, его антибактериальная активность сохранялась.
Позже высокую активность небольших доз препарата удалось объяснить благодаря определению механизма действия пенициллина. В случае применения антисептиков в больших концентрациях происходит разрушение стенок клеток бактерий. Пенициллин же проникает внутрь клетки, где блокирует образование биополимера, который необходим для роста клеточных стенок бактерий.
Впрочем, довольно скоро Флемингу удалось установить, что если ввести слишком небольшую дозу пенициллина или вводить его на протяжении небольшого периода времени, то колонии бактерий, которым удалось выжить, приобретают устойчивость к тем дозам препарата, которые были эффективными ранее. А еще позже ученые определили, что у стафилококков имеется врожденная способность синтезировать фермент, который разрушает пенициллин. Это в определенной степени антидот.
В настоящее время учеными достоверно установлено, что такого рода противостояния характерны не только в природных условиях между бактериями и грибами, но и между видами бактерий одного рода, поскольку в таком случае у них одинаковые субстрат и ниша, за которые необходимо бороться. Так, к примеру, в настоящее время различные виды стафилококков ведут борьбу за слизистую рта человека, в то же время вырабатывая антидоты и бактерицидные вещества.
Впрочем, в этом противостоянии нет ни победителей, ни побежденных, поскольку за миллионы лет такая эволюционная борьба множества видов микроорганизмов человеческой микрофлоры обернулась балансом, ставшим бесценным приобретением для организма в целом. Численность каждого вида строго ограничена бактерицидной активность других видов бактерий, размерами занимаемой ниши и иммунитетом организма. В частности, популяция золотистого стафилококка, который вызывает гнойные инфекции, может достигать численности до 10 тысяч бактерий в мл среды без вреда для человеческого организма, а бактерия клебсиелла может присутствовать в кишечнике или на коже здорового человека, и не причинять вред человеку, если численность популяции будет составлять не более 10 тысяч бактерий на грамм фекалий.
Ответить на вопрос, почему бактерии приобретают суперустойчивость к антибиотикам, поможет простой пример. В частности, можно представить себе, что в одном из небольших африканских государств происходит конфликт и одна из сторон получила оружие массового поражения. Если говорить о бактериях, то таким оружием массового поражения станут антибиотики, но не природного происхождения, а современные синтетические вещества, которые применяются в больших концентрациях.
После применения таких антибиотиков, за счет видов бактерий, наиболее чувствительных к препарату, произойдет сокращение видового разнообразия. Ниши, которые в результате освободятся, довольно быстро будут заняты теми видами бактерий, которые обладают способностью синтезировать антидоты. Таким образом, эволюционное преимущество получат колонии тех бактерий, которые обладают устойчивостью к антибиотикам, и в результате внутри одного вида генетическое разнообразие уменьшится. Следовательно, применяя антибиотики, человек неосознанно создает положительные условия для наиболее устойчивых штаммов бактерий. Именно по этой причине беспорядочное применение антибиотиков зачастую приводит к развитию хронических заболеваний, спровоцированных увеличением патогенной микрофлоры.
Человек, который является носителем такого рода бактерий, станет распространителем, передавая их своим родным, друзьям и знакомым, которые со временем начнут применять другие антибиотики. Таким образом, естественный отбор будет продолжаться, и бактерии, которые были устойчивы к одному виду антибиотиков, постепенно приобретут так называемую полирезистентность, то есть, устойчивость к различным видам антибиотиков. Именно такие патогены и получили название супербактерий.
Помимо этого, многие виды бактерий обладают способностью обмениваться при помощи плазмиды (горизонтального переноса генетических элементов, находящихся вне хромосомы) обмениваться генами резистентности. Большая опасность заключается в том, что устойчивость к большому количеству видов антибиотиков приобретают бактерии-анаэробы, для которых характерным является бескислородный метаболизм. Если человек получит травму, такие бактерии могут попасть в кровь, вызвав тяжелое заражение. Именно это и произошло в описанном выше случае, когда бактерии проникли в костную ткань. В попытках спасти женщину, врачи применили почти полтора десятка антибиотиков, и еще дюжина препаратов была протестирована на выделенной из очага инфекции культуре, однако все эти антибиотики оказались неэффективными.
Еще большая опасность состоит в том, что резистентность к антибиотикам могут приобретать разного рода патогенные бактерии, в частности, те, которые являются возбудителями сибирской язвы, сальмонеллеза и дизентерии. Даже несмотря на то, что все эти инфекции практически не распространены, возбудители их достаточно легко могут получить устойчивость к антибиотикам от бактерий нормальной микрофлоры за счет горизонтального переноса генов в плазмидах. Помимо того, довольно часто носителями опасных инфекций являются сельскохозяйственные животные. Необходимо отметить, что в данном случае резистентные бактерии в них распространены гораздо шире, нежели у людей. По словам специалистов, это объясняется тем, что в сельском хозяйстве антибиотики добавляют в корм для профилактики разного рода инфекций. Такие дозировки не приводят к уничтожению бактерий, а только не дают им размножаться. Но ведь еще Флеминг говорил о том, что использование малых доз антибиотиков приводит к снижению чувствительности к препаратам.
Группой исследователей Гарварда был проведен очень интересный эксперимент, в котором было показано, как растет число устойчивых штаммов бактерий в случае постепенного увеличения концентрации антибиотиков от минимума до тысячекратной.
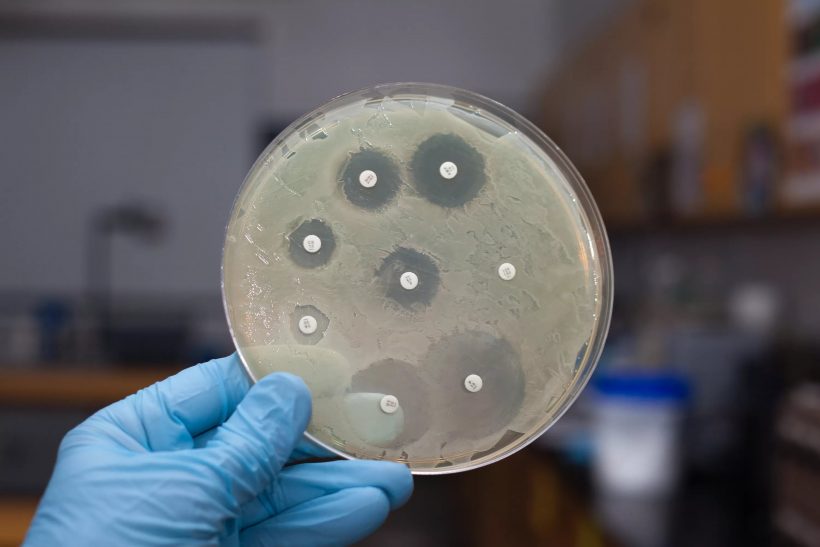
Таким образом, антибиотики необходимо принимать только согласно предписания врачей и только в рекомендованных дозах. В то же время, необходимо помнить, что если бактерия, которая спровоцировала заболевание, уже обладает устойчивостью к антибиотику, то даже прием препарата в больших концентрациях на протяжении длительного времени может оказаться неэффективным. В таком случае необходимо определить в лабораторных условиях чувствительность бактерии к препарату. С этой целью вместе с посевом бактерий на питательную среду укладывают бумажные диски, которые пропитаны разными видами антибиотиков. При появлении вокруг дисков прозрачных колец можно говорить об отсутствии роста культуры бактерий. Иными словами – она чувствительна к данному антибиотику. В случае отсутствия прозрачного кольца – можно говорить о наличии резистентности.
Благодаря результатам подобного исследования врачи уже смогут назначить один из антибиотиков узкого спектра действия, подавив патоген без ущерба для всей микрофлоры. Впрочем, подобного рода исследование стоит достаточно дорого и требует несколько дней. По этой причине, чтобы не терять время, врачи, как правило, не дожидаясь результатов исследования, назначают антибиотики. В большинстве случаев такой анализ не проводится вообще, и назначение антибиотика проводится без определения типа патогена. Таким образом, используется антибиотик широкого спектра действия. Это может иметь положительный эффект в некоторых случаях, однако в масштабах человечества подобная практика способствует тому, что проблема резистентности бактерий к антибиотикам лишь усугубляется.
Если говорить о разработках и испытаниях новых видов антибиотиков, то необходимо отметить, что данный процесс очень трудоемкий и дорогостоящий. На его реализацию необходимо порядка миллиарда долларов инвестиций и более десяти лет. Кроме того, антибиотики в большинстве случаев применяют короткими курсами, иногда всего несколько раз за всю жизнь. Если говорить о жаропонижающих, обезболивающих или гормональных препаратах, то они используются гораздо чаще и шире. А это, в свою очередь, делает их более привлекательными для инвестиций. За счет этого новые антибиотики внедряются в практику все реже.
Нежелание инвесторов вкладывать деньги в разработки новых препаратов вызваны еще и тем, что резистентность бактерий последних поколений все больше возрастает. В современной терапии врачи воздерживаются от широкого использования новых антибиотиков, применяя их лишь в крайних случаях в виде резерва. А это снижает спрос на эти препараты и лишает прибыли. Таким образом, получается, что резистентность бактерий, которая вызвана антибиотиками, тормозит разработки новых препаратов.
Бесспорно, открытие и активное применение в терапии антибиотиков стало настоящим прорывом в медицине. В момента своего появления, благодаря антибиотикам удалось спасти миллионы человеческих жизней. Но в настоящее время необходимо искать новые решения, которые помогут снизить зависимость медицины от применения антибиотиков.